
CTD در حقیقت یک فرمت رایج و استاندارد برای تنظیم و چیدمان پرونده های ثبت دارو است و اعتبار آن به تحقیقات علمی انجام شده برای فرمولاسیون و تولید دارو می باشد همچنین صحت و دقت اطالعات ارائه شده در پرونده و انطباق مستندات با فرمت CTD هم تاثیر زیادی بر روی اعتبار آن می گذارد .
CTD نتیجه کار ICH می باشد (سه منطقه اتحادیه اروپا، ژاپن و آمریکا) و از اول جولای 2003 اجباری شده است.
فهرست مطالب
- چرا CTD ؟
- نحوه تهیه CTD (فرمت صفحات C)
- الزامات لازم قبل از تهیه فرم CTD
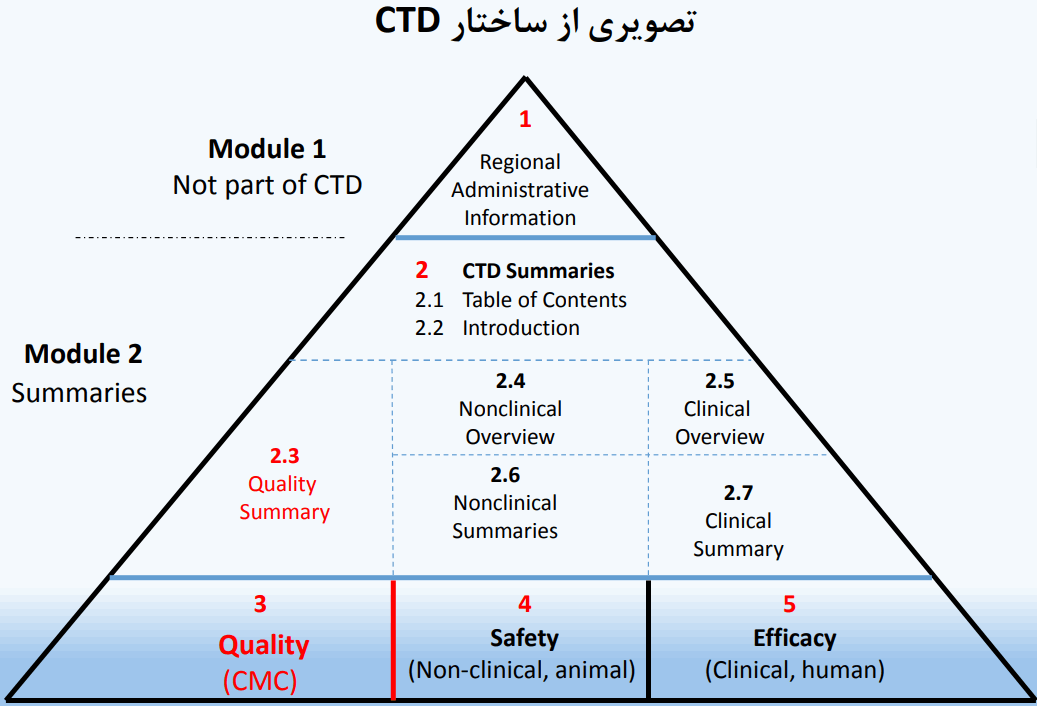
- ماژول 1
- ماژول 2
- ماژول 3 : کیفیت
- ماژول 4 : گزارش مطالعات غیر بالینی
- ماژول 5 : گزارش مطالعات بالینی
چرا CTD ؟
- دستورالعمل CTD به این منظور نیست که چه مطالعاتی لازم است بلکه فقط یک فرمت صحیح و کامل برای قرار دادن اطلاعات مورد نیاز در مکان های مناسب را بیان می کند.
- شرکت های داروسازی که می خواستند پرونده های محصولات دارویی خود را در کشور دیگری نیز ثبت کنند بدلیل الزامات متفاوت آن کشور لازم بود پرونده های خود را با چند نوع فرمت (فرمت اروپا، فرمت NDA و فرمت Gaiyo )تهیه کنند.
- یک فرمت بین المللی و مشترک جهت ارائه مستندات ثبت است و به همین دلیل باعث سهولت ارتباطات بین المللی در زمینه ثبت دارو می شود.
- شرکت های داروسازی راه کارهای متعددی برای تنظیم پرونده های خود داشتند این اختالف در تنظیم پرونده ها باعث می گردید:
- بررسی پرونده ها سخت شود.
- چیدمان های متعدد و مختلف اطلاعات می توانست منجر به حذف یا فراموش کردن قرار دادن اطلاعات مهم در پرونده و نهایتا رد پذیرش پرونده ثبت دارو شود.

نحوه تهیه CTD (فرمت صفحات C)
- در سراسر CTD ارائه اطلاعات باید واضح و شفاف باشد تا بررسی اطلاعات آسان باشد و بررسی کننده پرونده به سرعت با محتویات پرونده آشنا شود.
- تمامی متون (به استثناء تعهدنامه ها و فرم های ماژول 1) باید به زبان انگلیسی نوشته شوند.
- تمام صفحات باید دارای سربرگ باشند.
- سربرگ باید ارائه دهنده نام، دوز و شکل محصول دارویی، نام یا آرم کارخانه، شماره و نام ماژول مربوطه باشد.
در الگوی CTD به ترتیب:
- ماژول (Module)
- فصل (Volume)
- قسمت (Section)
- زیر قسمت (Subsection) وجود دارد
سند علمی رایج CTD از 5 ماژول تشکیل شده است: ماژول 1 خاص منطقه است. ماژول های ،2 ،3 ،4 و 5 برای همه مناطق مشترک طراحی شده اند.

الزامات لازم قبل از تهیه فرم CTD
قبل از شروع به فرمولاسیون می بایست مطالعات و اقدامات دیگری نیز صورت پذیرد:
- موجود بودن در فهرست دارویی ایران (IDL https://fda.gov.ir)
- نیازسنجی بازار (آمار فروش، رشد فروش در ایران و دنیا طی سال های اخیر و ...)
- بررسی معایب و مزایای داروی مورد نظر در مقایسه با داروهای مشابه
- بررسی فرمولاسیون های موجود در رفرنس ها و مراجع معتبر دنیا
- بررسی امکان تهیه ماده موثره و مواد جانبی مورد نیاز
- منابع معتبر ماده موثره دارای تایید GMP از سازمان غذا و دارو
- دارا بودن تجهیزات، امکانات، الزامات و شرایط تولیدی مورد نیاز شرکت متقاضی(پرخطر بودن محصول بر اساس OEB و فهرست NIOSH ، خط تولیدی مورد نظر و ...)
- دارا بودن امکانات آزمایشگاه مطابق با الزامات
- دارا بودن شرایط انبار
- درخواست ماده یا مواد موثره با خلوص و شکل مورد نیاز(پودر، کریستال ، پلت، مایع و ....)از منبع مورد تایید سازمان غذا و دارو
- بررسی قیمت تمام شده دارو
- تعداد پروانه های موجود از سازمان غذا و دارو (IRC)
- بررسی تعداد تولید کنندگان ماده اولیه دارویی توسط سازندگان داخلی و در صورت عدم تولید کننده داخلی استعلام و درخواست نمونه(sample )از سازندگان خارجی و یا درخواست از نمایندگان شرکت های مربوطه
- بررسی ثبت یا عدم ثبت گزارش بازدیدGMP سازنده ماده اولیه
- تهیه مواد جانبی مورد نیاز به مقدار لازم
- مهیا کردن اقلام بسته بندی مورد نظر ( BOTTLE ,VIAL ,PVDC ,PVC)
- تهیه استانداردها یا ورکینگ استاندارد ، ناخالصی ها جهت آنالیز
- بررسی متد آنالیز ماده یا مواد موثره (فارماکوپه ای یا غیر فارماکوپه ای)
- بررسی آنالیز محصول مورد نظر (فارماکوپه ای یا غیر فارماکوپه ای)
- آنالیز ماده یا مواد موثره دریافتی
- انجام فرمولاسیون مناسب
- آنالیز محصول فرموله شده
- در صورت تایید آنالیز و فرمولاسیون انجام شده ، مطالعات پایداری تسریع شده در فواصل زمانی مطابق با ICH و WHO بر روی فرمولاسیون انجام شود.

ماژول 1
ارائه دهنده اطلاعات اداری و تجویز دارو مربوط به هر کشور است و به دلیل اینکه اطلاعات، فرم ها و تعهدنامه های این ماژول در هر کشور مطابق با زبان و قوانین همان کشور تهیه می شوند این ماژول قسمتی از CTD محسوب نمی شود.


ماژول 2
2.1 CTD Table of contents of Module
2.2 CTD introduction
Summary Overall Quality 2.3 خلاصه ماژول 3 (کیفیت)
خلاصه باید بر روی موارد کلیدی حساس از محصول تاکید نماید (به استثنای جداول و نمودارها متن این خالصه نباید بیشتر از 40 صفحه باشد)
2.3 Drug Substance ماده موثره
2.3 Drug Product محصول دارویی
2.3 Appendixes
2.3 Additional information
2.3 Quality overall summary
S : Active substance(s)
S.1: General information
S.2:Manufacture of active substance(s)
S.3 : Characterization of active substance(s)
s.4 : Control of active substance(s)
s.5 : Reference standards or materials
s.6: Container / closure system
s.7 :Stability
2.3 Finished medicinal product
p1: Description and composition of the medicinal product
p2: Pharmaceutical development
p3 : Manufacture of the medicinal product
p4 : Control of excipients
p5:Control of medicinal product
p6:Reference standards and materials
p7:Container / closure system
p8:Stability
2.4 Non-Clinical Overview
2.5 Clinical Overview
2.6 Non-Clinical Written and Tabulated Summary
2.7 Clinical Summary
ماژول 3 : کیفیت
Contents of Table 3.1 فهرست مندرجات ماژول 3
3.2 Body of Data بدنه اطلاعات
Literature References 3.3 مراجع و منابع
توجه : برای یک محصول دارویی حاوی بیش از یک ماده دارویی اطلاعات خواسته شده برای قسمت S باید بطور کامل برای هر ماده دارویی ارائه شود.
ماژول 4 : گزارش مطالعات غیر بالینی
4.1 Table of Contents
4.2 Study Reports
4.2.1 Pharmacology
4.2.2 Pharmacokinetics
4.2.3 Toxicology
4.3 Literature references
ماژول 5 : گزارش مطالعات بالینی
5.1 Table of Contents
5.2 Tabular Listing of All Clinical Studies
5.3 Clinical Study Reports
5.4 Literature References











